Neurotoxikologie, -pharmakologie und -infektiologie
Entwicklung eines Serotyp-unabhängigen Botulinum Neurotoxin-Aktivitätstests zur Chargentestung – Der MoNLight-BoNT-Assay
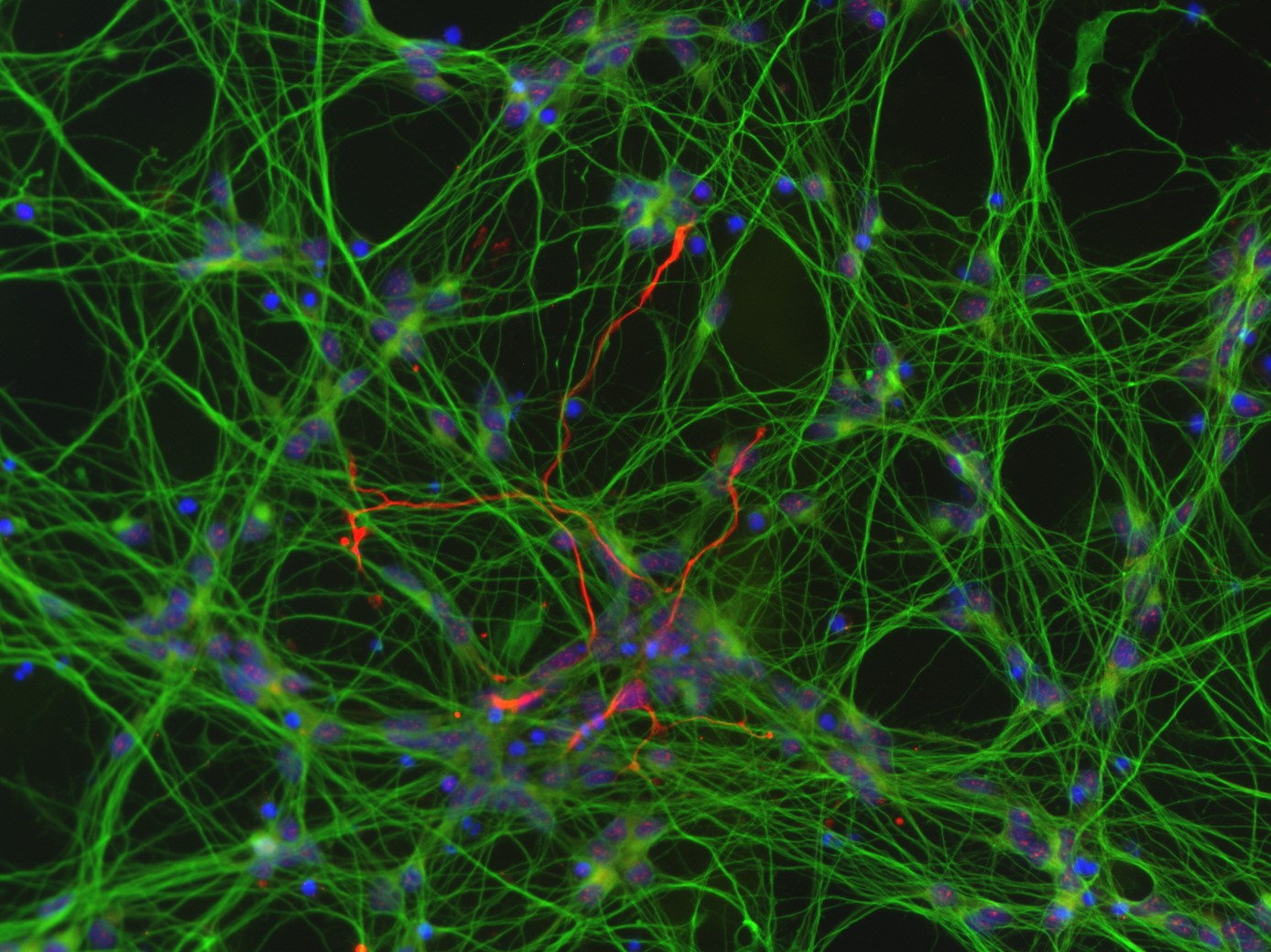
Botulinum Neurotoxine (BoNTs) werden zur Behandlung einer Reihe von neuromuskulären Fehlfunktionen sowie in der ästhetischen Medizin als Therapeutikum eingesetzt. Jede Charge pharmakologischer Zubereitungen dieser hoch potenten, von Clostridium botulinum-Bakterienstämmen produzierten, Neurotoxine muss auf ihre Aktivität überprüft werden. Obwohl Alternativen existieren, wird ihre Aktivität immer noch zu einem großen Anteil über den Maus-Letalitäts-Test bestimmt. Bisher zugelassene Ersatzmethoden sind ausschließlich für einzelne Präparate anwendbar, da hier hoch spezifische Neoepitop-Antikörper zum Nachweis der proteolytischen Aktivität der kleinen Untereinheit von BoNTs angewendet werden. Für die Chargentestung von BoNTs werden jährlich allein innerhalb Europas immer noch 400.000 Mäuse eingesetzt (Stand 2018). Neue Produkte, die ausschließlich im Tier getestet werden, werden von der Europäischen Arzneimittel-Agentur (EMA) nicht mehr akzeptiert. Mittlerweile sind neben den BoNT-Serotypen A-H über 40 Subtypen und Mosaikvarianten bekannt. Der pharmakologische Einsatz diverser Subtypen und neuer Produkte ist in Zukunft wahrscheinlich, da Resistenzen gegenüber einzelnen Produkte entstehen können. Ein Serotyp-unabhängiger, Tier-freier Assay, welcher für die Aktivitätstestung von BoNT-enthaltenden pharmakologischen Produkten übergreifend eingesetzt werden kann, existiert bisher noch nicht, wird aber dringend benötigt.
Der MoNLight-BoNT Assay (Motor Neuron Light-BoNT Assay) basiert auf aus humanen induzierten pluripotenten Stammzellen (iPSCs) differenzierten Motoneuronen (MNs). Die Aktivität der pharmakologischen BoNT-Produkte ist invers proportional zur Freisetzung eines Reporterenzyms (Luciferase) aus den Neurotransmitter-haltigen Vesikeln der MNs. Der Assay ist Serotyp-unabhängig und wäre daher eine geeignete Ersatzmethode, um den mit der Chargentestung verbundenen Maus-Letalitäts-Test vollständig zu ersetzen (Replace im Kontext der 3R).
Förderung: Die Entwicklung des MoNLight-BoNT Assays wurde durch das Bundesministerium für Bildung und Forschung (BMBF) unterstützt (FKZ 031L0132B, 4/2017-9/2020). Kooperation mit der Arbeitsgruppe von Prof. Dr. Gerhard Püschel, Universität Potsdam, Institut für Ernährungswissenschaft, Abteilung Biochemie der Ernährung
Ansprechpartnerinnen: Prof. Bettina Seeger
Publikation:
Schenke M, Schjeide BM, Püschel GP, Seeger B (2020) Analysis of Motor Neurons Differentiated from Human Induced Pluripotent Stem Cells for the Use in Cell-Based Botulinum Neurotoxin Activity Assays. Toxins (Basel) 12(5) doi:10.3390/toxins12050276
Schenke M, Prause H-C, Bergforth W, Przykopanski A, Rummel A, Klawonn F, Seeger B (2021) Human-Relevant Sensitivity of iPSC-Derived Human Motor Neurons to BoNT/A1 and B1. Toxins (Basel) 13(8):585 doi:10.3390/toxins13080585
Schjeide, B.-M. M., Schenke, M., Seeger, B. et al. (2022). Validation of a novel double control quantitative copy number pcr method to quantify off-target transgene integration after crispr-induced DNA modification. Methods and Protocols 5, 43. doi:10.3390/mps5030043
Massih, B., Veh, A., Schenke, M., Mungwa, S., Seeger, B., Selvaraj, B. T., Chandran, S., Reinhardt, P., Sterneckert, J., Hermann, A., Sendtner, M., & Lüningschrör, P. (2023). A 3D cell culture system for bioengineering human neuromuscular junctions to model ALS. Frontiers in cell and developmental biology, 11, 996952. 10.3389/fcell.2023.996952
Hutchings, A. J., Hambrecht, B., Veh, A., Giridhar, N. J., Zare, A., Angerer, C., Ohnesorge, T., Schenke, M., Selvaraj, B. T., Chandran, S., Sterneckert, J., Petri, S., Seeger, B., Briese, M., Stigloher, C., Bischler, T., Hermann, A., Damme, M., Sendtner, M., & Lüningschrör, P. (2024). Plekhg5 controls the unconventional secretion of Sod1 by presynaptic secretory autophagy. Nature communications, 15(1), 8622. 10.1038/s41467-024-52875-5

Chronic Pain in a dish - In vitro-Modellierung Neuronen-vermittelter chronischer Schmerzen in der Haut für Pharmakologie und Toxikologie
Chronische Schmerzen stellen ein erhebliches Gesundheitsproblem dar, von dem etwa 20 bis 50 % der Weltbevölkerung betroffen ist. Therapiemethoden werden größtenteils in Verhaltenstests mit induzierten Schmerzen an Nagern entwickelt. Dabei ist keine Schmerzbehandlung möglich, was zu einer schweren Belastung der Tiere führt. Dennoch sind im Tier entwickelte Therapeutika nicht immer auch im Menschen wirksam. Daher sollen zwei In vitro-Modelle in humanen Zellen entwickelt werden, um über Neuronen vermittelten chronischen Schmerz mit möglichst hoher Vorhersagekraft zu quantifizieren. Dafür werden Stammzell-abgeleitete sensorische Neuronen (1.) zur Entwicklung eines Luciferase-basierten Exozytose-Assays genutzt, um die vermehrte Ausschüttung der an der chronischen Schmerzreaktion beteiligten Neuropeptide (Substanz P und Calcitonin Gene-Related Peptide) einfach quantifizierbar zu machen. Außerdem soll (2.) ein innerviertes Hautmodell entwickelt werden, um Neuritenauswuchs und die Expression von mit chronischen Schmerzen assoziierten regulierten Genen von Schmerzrezeptoren und an der Reizweiterleitung beteiligte Ionenkanälen in vitro zu quantifizieren. Der Proof-of-concept für die Nutzung der Modelle in Pharmakologie und Toxikologie soll erbracht werden, indem induzierte Neuropeptid-Ausschüttung, induzierter Neuritenauswuchs und induzierte Genexpression, mit therapeutisch wirksamen Substanzen inhibiert oder über die Zugabe exogener Substanzen ausgelöst wird. So können molekulare Signalwege der chronischen Schmerzentstehung in vitro, direkt in humanen Zellen, modelliert werden, um unnötige Tierversuche zu vermeiden und für den Menschen wirksame und sichere Therapeutika zu entwickeln. Im Anschluss an das Projekt soll das Hautmodell über die Nutzung induzierter pluripotenter Stammzellen und primärer Zellen von Patienten auf die Modellierung der atopischen Dermatitis übertragen werden, um spezifische In vitro-Krankheitsmodelle zur Entwicklung neuer Therapien in Kooperation mit Industriepartnern in die Anwendung zu bringen. Weiterhin soll das Projekt als Grundlage für weitere Gebiets-übergreifende In Vitro-Modellierungen dienen, wie z.B. der Simulation von chronischen Gelenksschmerzen.
gefördert durch die Stiftung set
Ansprechpartnerinnen: Prof. Bettina Seeger und Doktorandin Kathrin Lämmerhirt-Simmons

PeriMyelinTox - Entwicklung eines auf menschlichen Stammzellen basierenden Tests zur Erfassung von Myelin-Toxizität, die die peripheren sensorischen und motorischen Funktionen beeinflusst
Dieses Projekt zielt darauf ab, eine entscheidende Lücke in der Bewertung von Neurotoxizität zu schließen, indem es eine neuartige In vitro-Methodik entwickelt, die gezielt auf die Myelintoxizität abzielt – einen entscheidenden Faktor, der periphere sensorische und motorische Funktionen beeinflusst. Aufbauend auf etablierten Wirkmechanismen (MoA) in der Neurotoxizität werden humane induzierte pluripotente Stammzellen zur Differenzierung in reife Motor- und sensorische Neuronen sowie Schwann-Zellen verwendet. Die neu zu entwickelnde Methode hebt sich von bestehenden In vitro-Methoden ab, indem sie sich auf die Myelintoxizität konzentriert, die bisher nicht in bestehenden In vitro-Ansätze integriert ist und somit zur Bewertung der Neurotoxizität herangezogen werden kann.
Im Bewusstsein der regulatorischen Notwendigkeit für schnellere und praxisrelevantere Bewertungen der Neurotoxizität strebt das Projekt an, eine effektive Methode zur Beurteilung der Myelintoxizität bereitzustellen. Die Methodik umfasst die Ko-Kultivierung von sensorischen oder motorischen Neuronen mit Schwann-Zellen in 3D-Sphären und in 2D-Konfigurationen. Der Plan beinhaltet die Charakterisierung von Zelltypen und die Untersuchung der Myelinbildung mittels immunzytochemischer Färbungen und RT-qPCR nach 4-8 Wochen in der Kultur. Ein entscheidender Aspekt der Studie ist die Erkundung optimaler Bedingungen für Hochdurchsatztests.
Meilensteine umfassen die Expression von Neuronen- und Schwann-Zellmarkern, die Bestimmung der optimalen 2D- oder 3D-Konfiguration für automatisierte Hochdurchsatz-Myelinquantifizierung und die wissenschaftliche Validierung der Testmethode. Das ultimative Ziel besteht darin, ein robustes Instrument zur Beurteilung der Myelintoxizität bereitzustellen, unter Verwendung eines Trainingssatzes von Testsubstanzen.
Förderung: Durch die Europäische Kommission co-finanziertes Partnership for the Assessment of Risks from Chemicals (PARC), PeriMyelinTox in WP 5.2.1.e
Ansprechpartner*innen: Prof. Bettina Seeger, Ph.D, Dr. Lisa Haiber und Ph.D. Studentin Cody Adams-Niedergeses
Publikation:Tal, T., Myhre, O., Fritsche, E., Rüegg, J., Craenen, K., Aiello-Holden, K., Agrillo, C., Babin, P. J., Escher, B. I., Dirven, H., Hellsten, K., Dolva, K., Hessel, E., Heusinkveld, H. J., Hadzhiev, Y., Hurem, S., Jagiello, K., Judzinska, B., Klüver, N., Knoll-Gellida, A., … Bartmann, K. (2024). New approach methods to assess developmental and adult neurotoxicity for regulatory use: a PARC work package 5 project. Frontiers in toxicology, 6, 1359507. doi.org/10.3389/ftox.2024.1359507
InfectNeuroDev - Von humanen Stammzellen-abgeleitete Neurosphären zur Erforschung der Konsequenzen einer Listerien-Infektion auf die Gehirnentwicklung - Funktionelle (Netzwerk-)Veränderungen durch Infektion mit Listeria monocytogenes
Im Zusammenhang mit Listeria monocytogenes-Infektionen während der Schwangerschaft, sind neurologische Entwicklungsstörungen als post-infektiöse Langzeitfolgen bei überlebenden Kindern beschrieben, wie kognitive Defizite, Lernbehinderungen oder Persönlichkeitsveränderungen. Nervenzellen wandern mehrere Zentimeter durch das wachsende Gehirn, um die richtige Position zu erreichen und die richtigen Verbindungen zu bilden, die eine normale Gehirnstruktur und -funktion gewährleisten. Unsere Hypothese ist, dass durch die Infektion mit Listeria monocytogenes überlebende neuronale Vorläuferzellen schneller maturieren, und ggf. aberrant migrieren. Durch Fehlmigration kann es dann zu fehlerhaften Synapsen kommen, die teilweise eine Übererregbarkeit des Netzwerkes bedingen könnten. Um die funktionellen (Netzwerk-) Veränderungen, die durch eine Infektion mit Listeria monocytogenes im sich entwickelnden Gehirn hervorgerufen werden, in vitro, in Zellen der Zielspezies Mensch, untersuchen zu können, werden Neurosphären (ein Modell für die Gehirnentwicklung) aus menschlichen induzierten pluripotenten Stammzellen im Hochdurchsatz generiert. Diese werden für Infektionsexperimente im Verbund genutzt. Anhand funktioneller Readouts wird untersucht, ob die Infektion mit Listeria monocytogenes das Wachstum von Neuriten, die Fähigkeit der wachsenden Neuronen zur Zellwanderung oder zur Bildung elektrisch aktiver Netzwerke in unterschiedlichen Entwicklungsstadien der Neurosphären beeinflusst. Bestätigt sich die Hypothese, sollen zusätzlich zugrundeliegende molekulare Signalwege untersucht werden, um langfristig therapeutische Targets identifizieren zu können. In einem Workshop wird interessierten Forschenden die Kultur und Analyse der humanen, fetalen Neurosphären nach Infektion vermittelt.
Förderung: Gefördert durch das Bundesministerium für Bildung und Forschung (BMBF) (FKZ 01KI2311B, 08/2023-07/2025) Kooperation mit Prof. Dr. Sonja Bröer, Institut für Pharmakologie und Toxikologie, Fachbereich Veterinärmedizin, Freie Universität Berlin
Ansprechpartner*innen: Prof. Bettina Seeger, Ph.D und Ph.D. Studentin Annika Fischer
NeuroIUGR - Alternativmethoden: Humanisierung eines Neurosphärenmodells für wachstumsbeschränkte Neuroentwicklung (Neuro-IUGR) – Analyse neuronaler Netzwerkaktivität im IUGR-Neurosphärenmodell
Das Projekt zielt darauf ab, ein innovatives In vitro-Modell zu entwickeln, das die durch intrauterine Wachstumsrestriktion (IUGR) induzierten Veränderungen in der Neuroentwicklung nachahmt. Dieses Modell dient zwei Hauptzwecken: der besseren Charakterisierung der grundlegenden Prozesse der Neuroentwicklung, die durch IUGR beeinflusst werden, und der Prüfung der Wirksamkeit und Sicherheit neuer neuroprotektiver Therapien. Im Rahmen einer Kooperation mit dem Bf3R in Berlin (Prof. Martha Barenys) wird ein Methodentransfer von Berlin nach Hannover durchgeführt. Dieser Transfer ermöglicht es, das entwickelte Modell in einem weiteren Forschungsumfeld zu etablieren und zu validieren. Das Projekt entwickelt ein auf menschlichen Zellen basierendes In vitro-Modell, das es erlaubt, die durch IUGR induzierten Veränderungen der Neuroentwicklung in den grundlegenden Funktionen der Neurogenese zu bewerten, ohne den Einsatz von Versuchstieren. Dieses Modell ersetzt das derzeitige Tiermodell, bei dem die IUGR durch einen chirurgischen Eingriff oder eine Ernährungseinschränkung in vivo induziert wird. In unserem Labor wird ein besonderer Fokus auf die Messung der Netzwerkaktivität der Neurosphären gelegt. Diese Analyse ermöglicht tiefere Einblicke in die funktionellen Auswirkungen der IUGR auf die neuronale Entwicklung und Konnektivität. Durch die Kombination des Methodentransfers und der spezialisierten Analyse der Netzwerkaktivität in unserem Labor strebt das Projekt eine umfassende Charakterisierung der IUGR-induzierten neuroentwicklungsbezogenen Veränderungen an. Dies bildet die Grundlage für die Entwicklung und Evaluierung neuer neuroprotektiver Strategien.
Förderung: Gefördert durch das Bundesministerium für Bildung und Forschung (BMBF) (FKZ 03LW0695, 06/2025-05/2028) Kooperation mit dem Bf3R Prof. Martha Barenys
Ansprechpartnerin: Prof. Bettina Seeger, Ph.D
Neuro Carb: Visualisierung und Analyse von Kohlenhydratstrukturen auf neuronalen Zelloberflächen in 3D-Zellkulturen unter physiologischen und stressinduzierten Bedingungen
Intestinale Organoide zur Erforschung von Wirt-Pathogen Interaktionen
Entwicklung eines In vitro-Modells zur Erforschung der Pathogenese-Mechanismen von Zoonoseerreger-induzierten Darmerkrankungen
Der Darm spielt für viele vom Tier auf den Menschen übertragbare Erkrankungen (sog. Zoonosen) eine entscheidende Rolle. Während verschiedene auf Zellkulturen basierende --Systeme für die Erforschung von Krankheitsmechanismen bei Mäusen, Ratten und dem Menschen zur Verfügung stehen, ist für die Untersuchung solcher Vorgänge bei Nutztieren (z. B. bei Schweinen, Rindern oder Geflügel) immer noch die Verwendung von direkt aus dem Tier entnommenen Primärzell- oder Organkulturen oder sogar der Einsatz von Tieren notwendig.
Aus diesem Grund sind neue Ansätze zur Entwicklung von -Modellen zur Erforschung zugrundeliegender molekularer Mechanismen von Infektionen bei Nutztieren von großem Interesse, insbesondere vor dem Hintergrund, dass Nutztiere häufig Träger bzw. Überträger zoonotischer Krankheitserreger sind. Daher sind die Wirkungen bakterielle Toxine in einer Cokultur von humanen intestinalen absorptiven Enterozyten und Becherzellen verglichen worden mit den gleichen Wirkungen in in 2D ausgesäten porzinen intestinalen Organoiden im Ussing-Kammer System, um die zugrundeliegenden Zellsysteme zu charakterisieren.
Förderung: Projekt A2 innerhalb des Verbundprojektes R2N – Replace und Reduce in Niedersachsen, gefördert durch das Niedersächsische Ministerium für Wissenschaft und Kultur (MWK) in Kooperation mit Prof. Dr. Gerhard Breves, TiHo, Institut für Physiologie und Zellbiologie
Ansprechpartner*innen: Prof. Bettina Seeger
Publikation:
Seeger B (2020) Farm Animal-derived Models of the Intestinal Epithelium: Recent Advances and Future Applications of Intestinal Organoids. Alternatives to laboratory animals : ATLA:261192920974026 doi:10.1177/0261192920974026
Hoffmann P, Burmester M, Langeheine M, Brehm R, Empl MT, Seeger B, Breves G (2021a) Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS One 16(10):e0257824 doi:10.1371/journal.pone.0257824
Hoffmann P, Schnepel N, Langeheine M, Künnemann K, Grassl GA, Brehm R, Seeger B, Mazzuoli-Weber G, Breves G (2021b) Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One 16(8):e0256143 doi:10.1371/journal.pone.0256143
Mergani, A., Meurer, M., Wiebe, E., Dümmer, K., Wirz, K., Lehmann, J., Brogden, G., Schenke, M., Künnemann, K., Naim, H. Y., Grassl, G. A., von Köckritz-Blickwede, M., & Seeger, B. (2023). Alteration of cholesterol content and oxygen level in intestinal organoids after infection with Staphylococcus aureus. FASEB journal: official publication of the Federation of American Societies for Experimental Biology, 37(12), e23279. doi.org/10.1096/fj.202300799R








