- Überschneidung von Themen der Allgemeinen Radiologie, Festkörperphysik und Koordinationschemie
- Chemische Synthesen und Charakterisierung von Koordinationsverbindungen und anderen Materialien mit Ionenaustauscheigenschaften
- Anwendung moderner spektroskopischer Methoden zur Elementanalytik und Speziation (Identifikation, Differenzierung und Strukturaufklärung) von Festkörpern, z.B. Infrarot-Spektroskopie (IR), Raman-Spektroskopie, Röntgendiffraktometrie (XRD), Röntgenfluoreszenzanalyse (RFA), Röntgenabsorptionsspektroskopie (XANES und EXAFS) und 57Fe-Mößbauer-Spektroskopie
Kontakt: Dr. rer. nat. Sascha A. Bräuninger und Dr. rer. nat. Damian A. Motz
Aktuelles Projekt: Untersuchungen zum so genannten Giese-Salz (Ammoniumeisen(III)-hexacyanoferrat(II), AEHCF)
Die erstmalige Synthese des Berliner Blaus (Preußisch Blau, Eisen(III)-hexacyanoferrat(II)) durch den Berliner Farbhersteller Johann Jacob von Diesbach im Jahre 1706 kann aus wissenschaftshistorischer Perspektive wohl als einer der wichtigsten Meilensteine der Entdeckungen im Bereich der Koordinationschemie betrachtet werden. Dies geht unter anderem auf die besonderen Eigenschaften der Verbindung zurück. So zeichnet sich das Berliner Blau zum einen durch eine ausgeprägte Schwerlöslichkeit vom mittleren sauren, über neutralen bis hin zum schwach alkalischen pH-Bereich aus. Neben anderen Ursachen resultiert diese hohe Schwerlöslichkeit daraus, dass das klassische Berliner Blau in den zwei verschiedenen Formen „lösliches Berliner Blau“ (kolloidal in Lösung, idealisierte Summenformel: K{Fe(III)[Fe(II)(CN)6]} ∙ x H2O) und „unlösliches Berliner Blau“ (nano- / mikrokristalliner Feststoff, idealisierte Summenformel: Fe(III){Fe(III)[Fe(II)(CN)6]}3 ∙ x H2O) dargestellt werden kann. Insgesamt zeichnen sich beide Formen durch eine intensive dunkelblaue Farbigkeit aus, die auf Charge-Transfer-Übergänge zwischen den in der koordinationspolymeren Festkörperstruktur vorliegenden und über Cyanid verbrückten Eisen(II)- und Eisen(III)-Kationen zurückzuführen ist. Diese Absorptionseigenschaften führten dazu, dass das Berliner Blau seit der Entdeckung besonders in der Anwendung als Farbpigment (Malerfarben, Wäscheblau u.a.) von großer Bedeutung sowie Bekanntheit war und dies auch gegenwärtig noch ist. Allerdings weisen das Berliner Blau sowie auch die davon abgewandelten sog. Berliner-Blau-Analoga (AxMy[M*(CN)6]z ∙ n H2O, A: Alkalimetall- / Ammonium-, M, M*: Übergangsmetallkationen) außerdem Ionenaustauscheigenschaften auf. So können die im klassischen Berliner Blau vorhandenen Kalium-Kationen (K+) beispielsweise gegen Caesium- (Cs+) oder auch Thallium-Kationen (Tl+) ausgetauscht werden. Im Falle des Austausches gegen Caesium-Kationen wird, im Vergleich zum Austausch mit anderen Alkalimetall-Kationen (Li+, Na+, K+), außerdem beobachtet, dass die kolloidale Löslichkeit besonders gering wird, es zu einem vermehrten Ausfallen der caesiumhaltigen Form kommt und somit Caesium-Kationen sehr selektiv gebunden werden. Aufgrund dieser Eigenschaften und der gleichzeitig unter physiologischen Bedingungen sehr geringen Resorbierbarkeit und Toxizität hat Berliner Blau eine ebenso wichtige Anwendung in der Human- und Veterinärmedizin als Antidot (Dekorporation sowie Verhinderung der Resorption) nach Inkorporation von Radiocaesium (134Cs, 137Cs) oder Thallium.
Das so genannte Giese-Salz (Ammoniumeisen(III)-hexacyanoferrat(II), NH4{Fe(III)[Fe(II)(CN)6]} ∙ x H2O, AEHCF) ist ein Ammonium-Derivat des klassischen („löslichen“) Berliner Blaus. Grundlage hierfür ist, dass Ammonium-Kationen (NH4+) eine besonders den Kalium-Kationen (K+) ähnliche Ladungsdichte aufweisen und somit nun diese die Funktion des Ladungsausgleichs in der Struktur übernehmen, wobei aber weiterhin die Ionenaustauscheigenschaften (insbesondere die Cs+-Selektivität) erhalten bleiben. Das Giese-Salz wurde in den 1970er bis 1990er Jahren an der Tiermedizinischen Hochschule Hannover von Werner Giese entdeckt und für Einsatzzwecke wie die Caesium-137-Dekorporation von Wild-, Nutz- und Haustieren (AEHCF als Futtermittelzusatzstoff) oder aber auch die Caesium-137-Dekontamination von Molke (AEHCF auf Trägermaterialien aufgebracht) charakterisiert und weiterentwickelt. Derzeit werden an der Stiftung Tierärztliche Hochschule Hannover Untersuchungen am Giese-Salz mit verschiedenen modernen spektroskopischen Methoden zur Erweiterung der Kenntnisse über die physikalisch-chemischen Eigenschaften der Koordinationsverbindung durchgeführt.
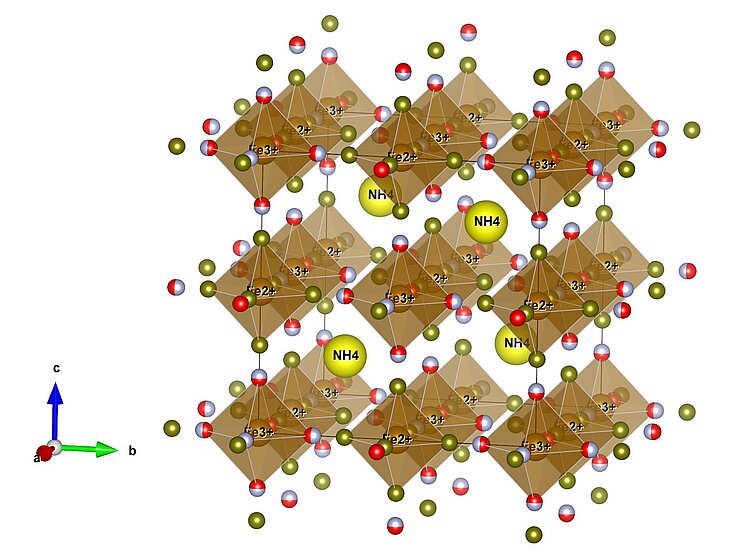
© S. Bräuninger
Literatur
Überblick zum Berliner Blau
Berliner Blau im 21. Jahrhundert - Kraft - 2022 - Chemie in unserer Zeit - Wiley Online Library
Publikation von W. W. Giese zum AEHCF an der Tiermedizinischen Hochschule Hannover im Jahr 1988
Aktuelle Studie, welche die Sicherheit des Konsumenten von AEHCF als tierischem Futtermittel betrachtet und belegt





