Mitarbeiterinnen und Mitarbeiter
- Prof. Dr. Gemma Mazzuoli-Weber, Leiterin Tel: +49-511-856-7543 E-Mail
- Kristin Elfers, PhD, wissenschaftliche Mitarbeiterin Tel: +49-511-856-7450 E-Mail
- Pascal Hoffmann, PhD, wissenschaftlicher Mitarbeiter Tel: +49-511-856-7764 E-Mail
- Susanne Hoppe, CTA Tel: +49-511-856-7356 E-Mail
- Kathrin Hansen, MTA Tel: +49-511-856-7527 E-Mail
- Kerstin Kiri, VMTA Tel: +49-511-856-7431 E-Mail
- Jolina Enes, Auszubildende Tierpflegerin Tel: +49-511-856-7345 E-Mail
- Michael Rohde, Tierpfleger Tel: +49-511-856-7335 E-Mail
- Yvonne Ambrecht, Tierpflegerin Tel: +49-511-856-7334 E-Mail
- Sophia Mayr, Doktorandin Tel: +49-511-856-7405 E-Mail
- Alina Sehnert, Doktorandin Tel: +49-511-856-7405 E-Mail
- Masina Plenge, Doktorandin Tel: +49-511-856-7626 E-Mail
Ausstattung
- 3x Ultrafast-Neuroimaging-Setups zum Live-Cell-Imaging mit spannungssensitiven Farbstoffen sowie Ca2+-Imaging
- Makroskop für Ca2+-Imaging mit großem Blickfeld
- 16-Kanal-Organbad-System
- Fluoreszenzmikroskop für Immunfluoreszenz-Studien
- 4-Kanal-Ussing-Kammer für elektrophysiologische Untersuchungen an Epithelien


Forschung
Seit vielen Jahren ist bekannt, dass das enterische Nervensystem (ENS) unabhängig vom Zentralnervensystem agieren kann und in der Lage ist, alle gastrointestinalen Funktionen isoliert zu regulieren. Nichtsdestotrotz mangelt es an Daten bezüglich der neuronalen Schaltkreise, welche diese Funktionen regulieren.
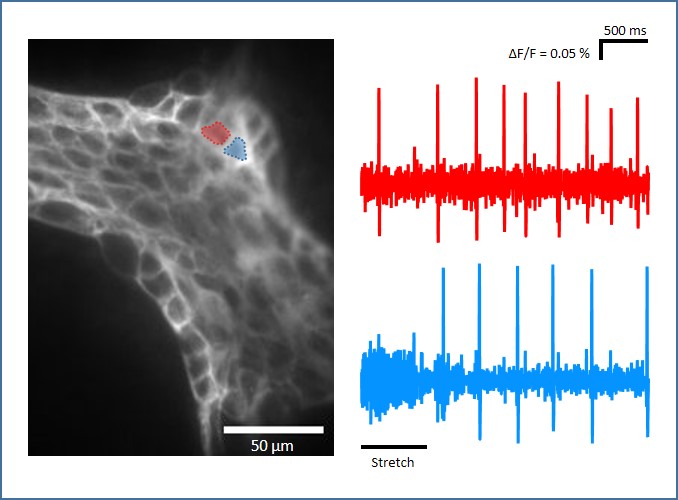
Der Forschungsgruppe ist es gelungen, mechanosensitive enterische Neurone (MEN) zu identifizieren und zu charakterisieren. Diese Neurone besitzen einen Zellkörper sowie mehrere mechanosensitive Zellfortsätze. Darüber hinaus haben wir gezeigt dass eben jene Fortsätze sowohl afferente, als auch efferente Funktionen erfüllen. Interessanterweise sind MEN multifunktional: Sie besitzen einerseits sensorische Eigenschaften, da sie beispielsweise auf mechanische Stimuli reagieren, fungieren andererseits jedoch auch als Motoneuronen, welche die Basis der Darmperistaltik darstellen. Wir haben gezeigt, dass MEN verschiedene Phänotypen besitzen und sensitiv gegenüber Druck- oder Zugkräften sind. Eine Gemeinsamkeit aller MEN ist, dass sie schnellen synaptischen Input erhalten. Dies deutet darauf hin, dass sie Teil eines Netzwerkes sind, dessen Aktivität sowohl durch neuronalen, als auch nicht-neuronalen Input moduliert werden kann. Das Konzept multifunktionaler MEN ist speziesübergreifend (Nager, Mensch) für alle Abschnitte des Gastrointestinaltraktes (Magen, Dünn- und Dickdarm) gültig.
Forschungsmethoden

Neuroimaging mit spannungs- und kalziumsensitiven Farbstoffen
Änderungen des Membranpotentials sowie des intrazellulären Kalziumspiegels können mithilfe von spannungs- und kalziumsensitiven Farbstoffen registriert werden.
Zur Detektion dieser schnellen Ereignisse sind Kameras mit einer enorm hohen (>1 KHz) Bildrate nötig. Der Vorteil der Anwendung optischer Methoden in der Neurophysiologie liegt darin, dass ganze Populationen an Neuronen gleichzeitig untersucht und Netzwerkinteraktionen aufgeklärt werden können.
Video einer mechanische Stimulation eines enterischen Ganglions
Video einer intraganglionären Injektion und konsekutiver Muskelkontraktion
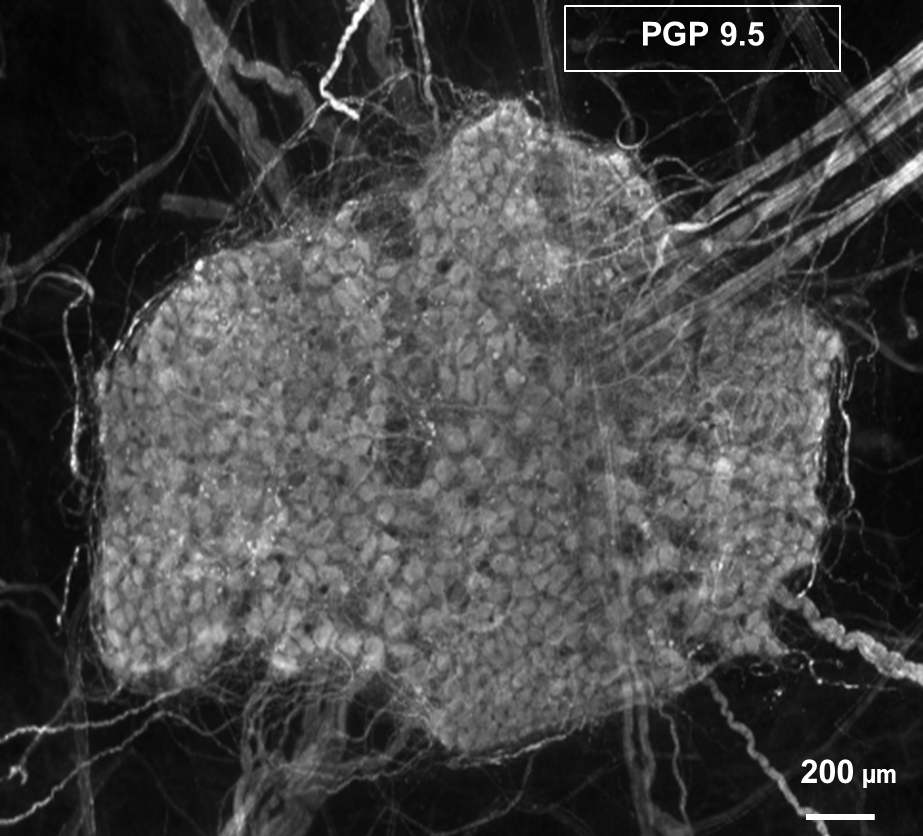
Gewebe Präparation: Plexus myentericus des menschlichen Dickdarms
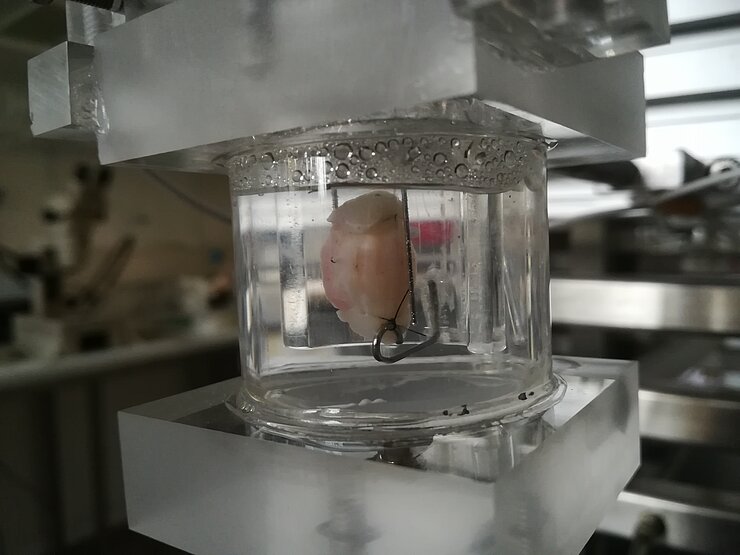
Motilitätmessungen im Organbad
Mithilfe von Kraftaufnehmern wird in-vitro die Kontraktilität isolierter Vormagen-, Magen- und Darmpräparate untersucht. Dieses Modell eignet sich hervorragend für pharmakologische Studien, wobei zeitgleich 16 getrennte Organbäder benutzt werden können. Beispielsweise werden funktionelle Untersuchungen am Pansengewebe in der Motilitätsanlage durchgeführt. Diese Methode ermöglicht die Untersuchung der Wirkung verschiedener Substanzen auf die Muskelaktivität unter basalen und stimulierten Bedingungen.
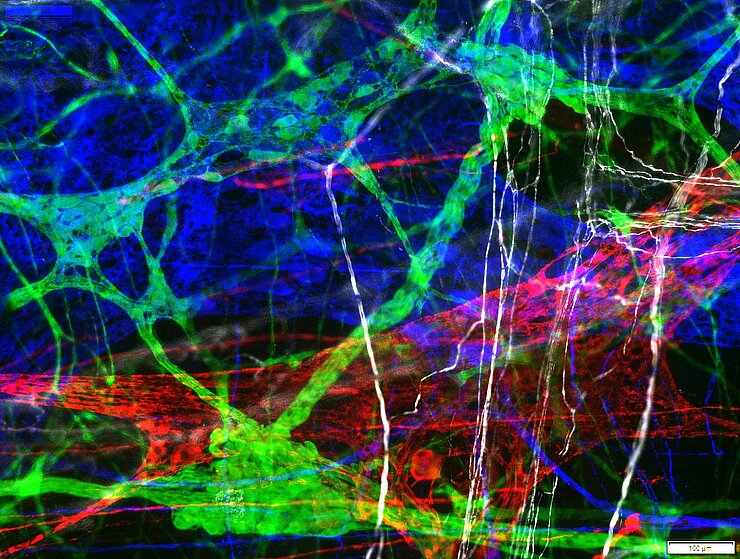
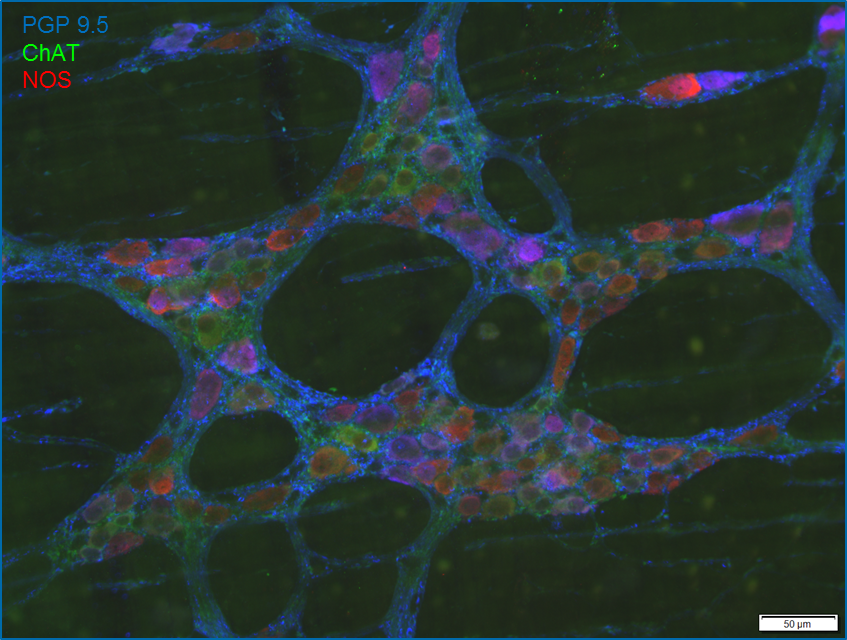
Immunhistochemie/Immunofluorezenz
Enterische Neuronen exprimieren verschiedene Neurotransmitter, die den neurochemischen Code einer Zelle ergeben. Diese Kodierung charakterisiert die Funktion der Neurone. Unser Ziel ist die vollständige Entschlüsselung dieser Kodierung im ENS nebst den assoziierten Zellen. Mit der bereits bekannten Kodierung ist es gelungen, Plastizität und Krankheits-assoziierte Änderungen im enterischen Nervensystem nachzuweisen und zu spezifizieren.

Voltage-Clamp-Ussing
Messung von Eigenschaften der Durchlässigkeit von Epithelgeweben. Es können damit Transport- und Barrierefunktionen des lebenden Gewebes erfasst und quantifiziert werden.
Durch die Zugabe von verschiedenen sekretionssteigernden bzw. -hemmenden Substanzen lassen sich zelluläre Mechanismen, nervale Schaltkreise, beteiligte Transmitter und Rezeptoren bzw. Kanäle identifizieren.



