Mitarbeiterinnen und Mitarbeiter
- Melanie Brede, PhD, Wissenschaftliche Mitarbeiterin Tel.: +49 511 856 7629 E-Mail
- Dr. rer. nat. Alexandra Muscher-Banse, Wissenschaftliche Mitarbeiterin Tel.: +49 511 856 7430 E-Mail
- Yvonne Ambrecht, Tierpflegerin Tel.: +49 511 856 7334 E-Mail
- Marion Burmester, VMTA Tel.: +49 511 856 7236 E-Mail
- Madeleine Heinzendorff, Auszubildende Tierpflegerin Tel.: +49 511 856 7375 E-Mail
- Pascal Hoffmann, PhD Tel.: +49 511 856 7764 E-Mail
- Karin Hustedt, Biologielaborantin Tel.: +49 511 856 7281 E-Mail
- Lucia Johannigmann, Doktorandin Tel.: +49 511 856 7626 E-Mail
- Michael Rohde, Tierpfleger Tel.: +49 511 856 7335 E-Mail
- Nadine Schnepel, BTA Tel.: +49 511 856 7529 E-Mail
- Dirk Voigtländer, Biologielaborant Tel.: +49 511 856 7333 E-Mail
- Sarah Weber, Doktorandin Tel.: +49 511 856 7626 E-Mail
- Luisa Sophie Zillinger, Doktorandin Tel.: +49 511 856 7626 E-Mail
Forschung
Die Aufnahme, Verdauung und Resorption von Nahrung dient der Versorgung des Körpers mit Nährstoffen, die als Energiequelle lebenswichtige Prozesse im Körper antreiben und als Baustoffe für Körpersubstanz dienen. Darüberhinaus beeinflusst die Zusammensetzung der aufgenommenen Nahrung den Intermediärstoffwechsel und Hormonhaushalt, sowie über die Ausscheidung von Stoffwechselendprodukten auch die Umwelt.
In der Arbeitsgruppe Gastrointestinale Physiologie beschäftigen wir uns mit den Einflüssen der aufgenommenen Nahrung auf Wachstum, Gesundheit und Stoffwechsel der Tiere, den Mechanismen der Verdauung und der Resorption, sowie der Exkretion der Nährstoffe und deren Auswirkungen auf Stoffwechselprozesse.
Ein besonderer Fokus liegt hier auf der mikrobiellen Verdauung der Nahrung im Vormagensystem, der Reduktion von Stickstoff- und Methanemissionen durch Wiederkäuer wie auch dem Einfluss diätetischer Faktoren (Stickstoff, Calcium oder Phosphor) auf das Wachstum von jungen Wiederkäuern.
Schwerpunkte
Schwerpunkt: Mikrobielle Fermentation im Vormagensystem beim Wiederkäuer
Wiederkäuer zeichnen sich durch ein sogenanntes Vormagensystem aus, indem pflanzliche Nahrung mit Hilfe von Bakterien, Protozoen und Pilzen effizient abgebaut werden kann und somit in für den Wiederkäuer nutzbare Substrate aufgeschlossen wird. Die Gemeinschaft der Mikroorganismen im Pansen ist ein hochkomplexes System das sowohl von der Fütterung, als auch der Genetik des Wirtstieres beeinflusst wird und auch im Zusammenhang mit dessen Produktivität steht. Mittels der sog. Rumen Simulation Technique (Pansensimulationstechnik), einer in vitro Apparatur zur Untersuchung des Pansenstoffwechsels untersuchen wir den Einfluss verschiedener Futtermittel oder Futtermittelzusatzstoffe auf die Fermentationsleitung im Pansen und die Zusammensetzung des Pansenmikrobioms. Darüber hinaus werden die Auswirkungen verschiedener physiologischer und pathologischer Bedingungen auf klassische Fermentationsparameter und die mikrobielle Gemeinschaft untersucht. Hierfür wurde beispielsweise ein Modell zur Erzeugung einer subklinischen Azidose im RUSITEC-System etabliert und charakterisiert. Darüberhinaus testen wir z.B. Ansätze zur Verminderung der Methanemissionen und zur Verbesserung des Faserabbaus in Biogasanlagen. Zur detaillierten Analyse des Pansenmikrobioms und –metaboloms arbeiten wir mit Arbeitsgruppen mit Sequenziereinrichtungen und mit Metabolomics-Einrichtungen zusammen.
Link Artikel TiHo Anzeiger (02/2019): Die klimafreundliche Kuh?
Dr. rer. nat. Alexandra Muscher-Banse
Schwerpunkt: Einfluss einer Stickstoff-Reduktion auf den Vitamin D-Stoffwechsel bei wachsenden Ziegen
Eine Stickstoff (N)-verminderte Fütterung von Wiederkäuern ist im Hinblick auf Ressourcenschonung sowie Umwelt- und Klimaschutz erstrebenswert. Aufgrund des ruminohepatischen Kreislaufs kann der Wiederkäuer in Zeiten verminderter Angebote an N den Metabolismus anpassen und Wachstum bzw. Stoffwechsel aufrecht halten. Aus eigenen Untersuchungen an wachsenden Ziegen mit einer N-reduzierten Fütterung wurde gezeigt, dass es zu einer Unterbrechung der somatotropen Achse und somit zu verminderten insulinähnlichen Wachstumsfaktor 1 (IGF1)-Spiegeln kommt. Grund für diese Unterbrechung sind vermutlich verminderte Insulin-Spiegel, die die Expression des Wachstumshormon-Rezeptors in der Leber hemmen. Verminderte IGF1-Spiegel modulieren u.a. den Vitamin D Stoffwechsel, in dem das zentrale Enzym, die 1-α-Hydroxylase, vermindert exprimiert wird und so viele Vitamin D-abhängige Stoffwechselprozesse gehemmt werden wie z.B. die intestinale Absorption von Calcium. Die 1-α-Hydroxylase sorgt für die Bildung von aktivem Vitamin D3, dem Calcitriol. So soll die Modulation der Calcitriolsynthese in der Niere durch eine N-reduzierte Diät bei wachsenden Ziegen charakterisiert werden. Die Ergebnisse dieser Arbeit sollen zu einem besseren Verständnis möglicher Interaktionspartner wie auch deren diätetische Regulierbarkeit durch N bei wachsenden Wiederkäuern beitragen. Zudem liefern diese Stoffwechsel-Daten Informationen zur Beurteilung der Tiergesundheit.
Link Artikel BJN (03/2020): https://pubmed.ncbi.nlm.nih.gov/31775916/
Methoden/Austattung

Pansensimulationstechnik (Rumen simulation technique, RUSITEC)
Die Pansensimulationstechnik (RUSITEC) stellt eine seit langem etablierte Methode dar, um die mikrobielle Fermentation im Pansen in vitro zu simulieren. Die Fermenter werden hierfür zu Versuchsbeginn mit flüssigem und festem Panseninhalt von Wiederkäuern befüllt, täglich mit einer entsprechenden Futterration und kontinuierlich mit einem dem Wiederkäuerspeichel nachempfunden Puffer versorgt. Ablaufende Flüssigkeit und entstehendes Fermentationsgas werden gesammelt. Mittels dieser Methode können über mehrere Wochen die Auswirkungen von z.B. verschiedenen Futtermitteln oder Futtermittelzusatzstoffen auf die mikrobielle Fermentation (Bestimmung der Konzentration kurzkettiger Fettsäuren per Gaschromatografie, photometrische Ammoniak- und Laktat-Bestimmung, Produktion von Kohlendioxid und Methan) und die mikrobielle Gemeinschaft erfasst werden. Um die Gemeinschaft der Bakterien und Archaeen im Rusitec im Detail zu untersuchen kann die DNA für Next-Generation Sequencing oder real-time PCR Analysen gewonnen werden.
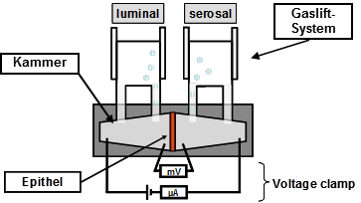
Die Ussing Kammer Technik: Eine in vitro Methode zur Untersuchung elektro- und transportphysiologischer Mechanismen am intakten Epithel oder an Zellkultursystemen
Die Aufnahme von Nährstoffen in den Körper erfolgt durch komplexe Transportvorgänge in den Epithelien der Schleimhäute des Magen-Darm-Traktes. Diese Transportvorgänge werden durch verschiedene Faktoren wie die Zusammensetzung der Nahrung, das Alter und den Hormonstatus der Tiere reguliert, können aber auch durch Erkrankungen und Infektionen verändert sein. Da die Nährstoffaufnahme eine Grundlage der bedarfsgerechten Versorgung des Organismus darstellt, sind ihre Mechanismen und deren Regulation Gegenstand der Forschung. Die bereits 1951 von USSING und ZERAHN vorgestellte und seitdem kontinuierlich weiterentwickelte Ussing Kammer ermöglicht es, Funktionsstudien an intakten Epithelien (aus Schlacht- und Biopsiematerial, Zellkulturen) unter kontrollierten in vitro Bedingungen über mehrere Stunden durchzuführen.

Gaschromatografie
Ein wesentliches Merkmal von mikrobiellen Fermentationsprozessen ist die Produktion von kurzkettigen Fettsäuren. Für die Analyse von kurzkettigen Fettsäuren in Pansen- oder Darminhalt steht ein GC2025 (Shimadzu) zur Verfügung.

Photometrie
Im Institut sind verschiedene photometrische Protokolle z.B. zur Bestimmung von Calcium, Gesamtprotein, Harnstoff, Laktat, NH3-N, Phosphat und von Enzym-Aktivitäten (z.B. alkalische Phosphatase, Na+/K+-ATPase) etabliert.

Real-time PCR
Die Genexpressionsanalyse der am Nährstofftransport beteiligten Strukturen (Transporter, Kanäle, Rezeptoren, intrazelluläre Signalkaskaden,…) erfolgt mittels Real-time PCR. So wird u.a. untersucht inwiefern die Menge an spezifischen Genprodukten durch unterschiedliche Faktoren der Nahrung auf RNA-Ebene beeinflusst werden können. Dafür stehen zwei chemische Verfahren für die Quantifizierung von mRNA mittels Real-time PCR zur Verfügung: TaqMan Sonden-basierte Chemie und SYBR Green Farbstoff-basierte Chemie.
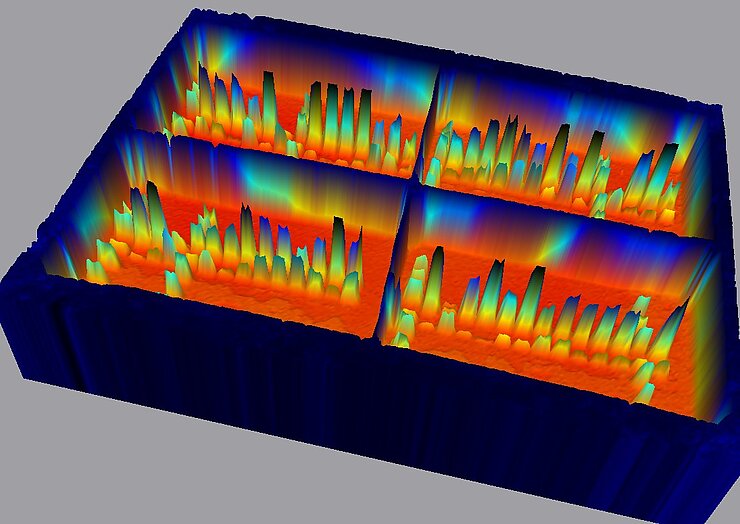
Western Blot Analyse
Neben der Genexpression können Faktoren der Nahrung auch translationale Prozesse wie die Proteinexpression modulieren. Der Nachweis von Proteinen anhand spezifischer Antikörper wie auch deren Quantifizierung erfolgt u.a. durch die Western Blot Analyse oder ELISA. Anhand des Nachweises von Chemiluminescence mittels eines ChemiDoc-Systems oder eines Farbumschlags kann die Menge an untersuchten Proteinen quantifiziert werden.
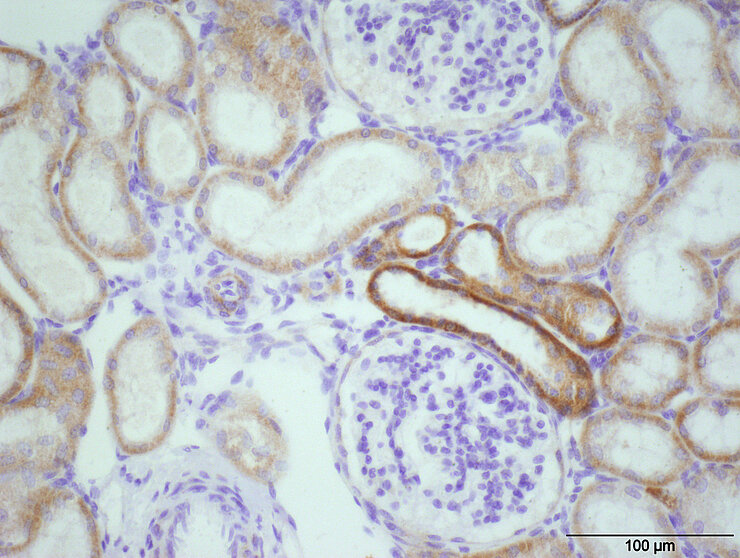
Immunohistochemie
Neben der Quantifizierung der Proteinexpression kann die Lokalisation der untersuchten Proteine in einem Organsystem durch die Immunhistologie näher charakterisiert werden. Der Nachweis erfolgt hier auch durch das Binden von spezifischen Antikörpern an ein Epitop jedoch in einem Gewebeschnitt. Die Visualisierung erfolgt durch verschiedene Detektionssysteme.

Fütterungsversuche
In den institutseigenen Stallungen können zu Versuchszwecken Schafe, Ziegen, Schweine oder Geflügel gehalten werden.



