Während der letzten drei Jahrzehnte hat sich unsere Arbeit auf das Gebiet des Protein- und Membrantransports durch die molekulare Analyse der Pathogenese von Darmerkrankungen konzentriert und dazu beigetragen molekulare Mechanismen zu entschlüsseln, die an diesen Prozessen beteiligt sind. Durch die Verwendung von Geweben von Patienten mit intestinalen Kohlenhydrat-Malabsorptionsstörungen, intestinalen Caco-2- oder HT-29-Zellen oder stabil transfizierten polarisierten oder nicht-polarisierten Zellen hat sich ein umfangreiches Wissen über die molekularen Grundlagen des intrazellulären Transports und der Proteinfaltungsmechanismen angesammelt. Die wichtigsten Entdeckungen beziehen sich auf die folgenden Forschungsrichtungen:
- Zelluläre Mechanismen in der Darmzellbiologie, die für den polarisierten und vesikulären Transport von Darmproteinen relevant sind, Implikationen von N- und O-verknüpfter Glykosylierung und Lipid-Mikrodomänen beim intrazellulären Targeting von Darmproteinen und Qualitätskontrollmechanismen;
- Genetische, zelluläre und biochemische Grundlagen der angeborenen Darmerkrankungen Saccharase-Isomaltase-Mangel (CSID) und Lactase-Mangel (CLD) und Definition dieser Erkrankungen als Proteintransport- und Faltungskrankheiten; Etablierung des Konzepts der Symptomheterogenität und der Existenz eines Schweregradienten bei CSID;
- Funktionelle Varianten von Saccharase-Isomaltase, die möglicherweise mit dem Reizdarmsyndrom (RDS) in Verbindung gebracht werden;
- Zelluläre und biochemische Mechanismen bei der Pathogenese der Mikrovillus-Einschlusskrankheit (MVID);
- Targeting und endozytische Mechanismen von Gliadinpeptiden in der Pathogenese der Zöliakie.
Aktuelle Projekte
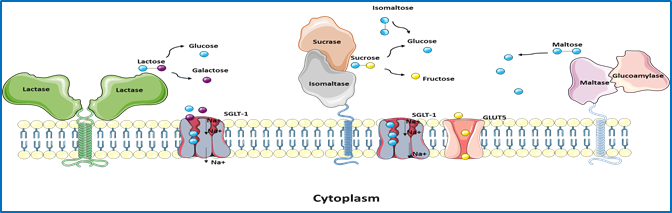
Die genetisch bedingte Kohlenhydratmalabsorption bei angeborenem Saccharase-Isomaltase-Mangel und Reizdarmsyndrom
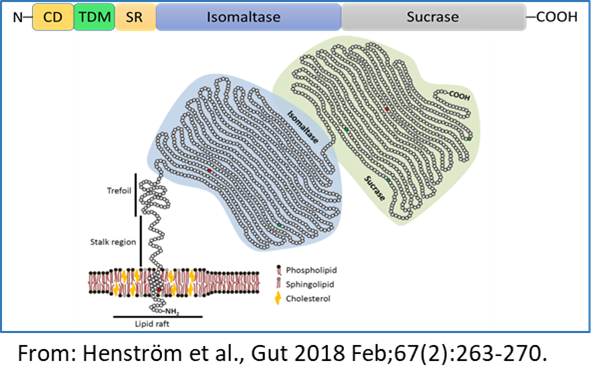
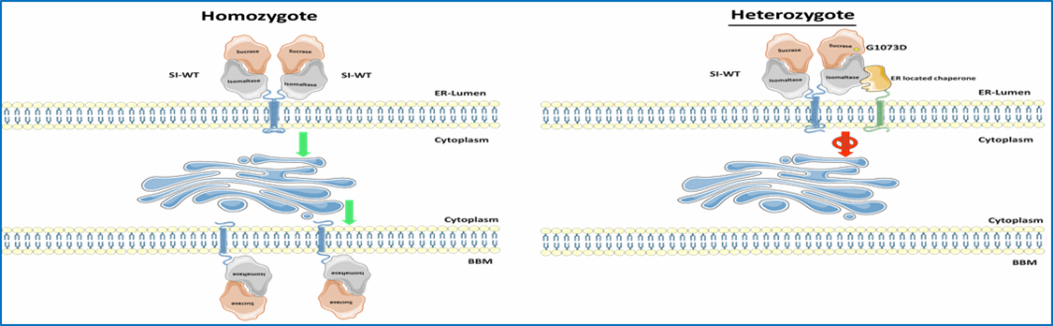
Die letzten Stufen der Verdauung von α-glykosidischen Kohlenhydraten erfolgt im Dünndarm durch die α-Glykosidasen Saccharase-Isomaltase (SI, EC 3.2.148 und 3.2.1.10) und Maltase-Glucoamylase (MGAM¸ EC 3.2.1.20 und 3.2.1.3). Reduzierte Expressionsniveaus oder das vollständige Fehlen von intestinalen Disaccharidasen an der Zelloberfläche der Enterozyten ist mit Kohlenhydrat-Maldigestion und Malabsorption verbunden, die am bemerkenswertesten in mehreren Fällen von genetisch bedingtem Saccharase-Isomaltase-Mangel (CSID) beschrieben wird. Im Gegensatz zu CSID ist das Reizdarmsyndrom (RDS) eine häufige funktionelle gastrointestinale Störung (FGID), von der 10-15% der Erwachsenen und Kinder weltweit betroffen sind. Biochemische, zelluläre und funktionelle Analysen von SI-Mutationen etablierten das Konzept der phänotypischen Heterogenität von CSID und klassifizierten SI-Mutanten basierend auf ihrer intrazellulären Lage und Funktion sowie dem genetischen Vererbungsmuster, homozygot oder kombiniert heterozygot. Das Konzept der Heterozygotie bei CSID wurde ebenfalls kürzlich diskutiert.
Aufgrund mehrerer häufiger Symptome bei CSID, wie Durchfall, Bauchkrämpfe und Blähungen, wurde eine mögliche Rolle von SI (und wahrscheinlich auch MGAM) bei der Pathogenese von RDS-D (D = Diarrhoe) vorgeschlagen.
In diesem Projekt wollen wir die Rolle von SI und MGAM in der Pathogenese der genetisch bedingten Kohlenhydratmalabsorption bei CSID und RDS untersuchen.
- Wir werden zunächst das Protein-Targeting und die Aktivitätsprofile von SI-Mutanten im heterozygoten Vererbungsmuster in CSID im Vergleich zu Wildtyp-SI analysieren. In parallelen Studien wird der Einfluss von MGAM auf die gesamte Kohlenhydratverdauungskapazität in diesem Zellmodell untersucht.
- In einem ähnlichen Versuchsaufbau werden wir SI-Polymorphismen beim RDS und ihre mögliche Assoziation mit MGAM untersuchen. Dazu werden die weit verbreitete Genvariante V15F und andere pathogene SI-Varianten mit reduzierter enzymatischer Aktivität bei RDS-Patienten untersucht.
- Ein Breitscreen-Screening wird durchgeführt werden, um Polymorphismen von SI und anderen kohlenhydratverdauenden Enzymen (CDE; z.B. MGAM, Lactase, pankreatische Amylase) mittels Targeted Next Generation Sequencing von Proben aus verschiedenen EU und US Neurogastroenterologie Zentren zu identifizieren. Nach ähnlichen Verfahren wie oben werden die Auswirkungen potenzieller Mutationen, die in diesen Enzymen gefunden werden, auf ihr intrazelluläres Targeting und ihre Enzymfunktion analysiert, mit dem ultimativen Ziel, ein eindeutiges Grundwissen über die Ätiologie von RDS, die für CDE relevant sind, zu erhalten..
Diese Studien sollen unser Verständnis der molekularen Grundlagen der Kohlenhydratmalabsorption bei funktionellen Magen-Darm-Erkrankungen grundlegend erweitern.
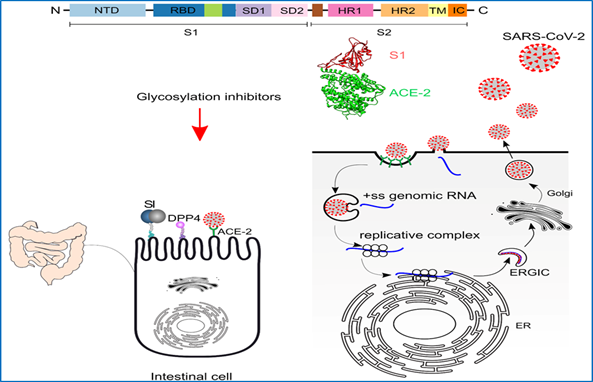
Infektion von Darmzellen durch SARS-CoV2 und seine Auswirkungen auf die Darmfunktion
CoVid-19 ist durch eine Infektion der Atemwege durch das SARS-CoV-2 gekennzeichnet. Neben den Atemwegen sind auch andere Organe beteiligt, z.B. der Darmtrakt. Die Bedeutung der Darminfektion wird zunehmend erkannt. Bei einem großen Teil der pädiatrischen Patienten wurde das Virus in Rektumabstrichen nachgewiesen und eine Virusausscheidung aus dem Darm wurde auch bei negativen Mundabstrichen festgestellt. Daher müssen eine verlängerte Virusausscheidung und eine fäkal-orale Übertragung in Betracht gezogen werden. Unterstützt wird diese Vorstellung durch den Nachweis des Virus im Abwasser.
Ziel dieses Projektes ist die Anwendung von Darmzellkulturen und Darmorganoiden zur Charakterisierung der Infektion differenzierter Darmepithelzellen durch SARS-CoV-2.
Dieser in-vitro-Infektionsansatz zielt auf die folgenden Schwerpunkte ab:
1. Charakterisierung der Replikationseffizienz von SARS-CoV-2 (Virusausbeute, Virusausgang, Viruseintritt, apikal, basolateral).
2. Lokalisierung des zellulären Rezeptors/der zellulären Rezeptoren in menschlichen Caco-2-Darm-Zellen.
3. Untersuchung des Traffickings des zellulären Rezeptors/der zellulären Rezeptoren, Bestimmung und anschließenden Modulation ihres Interaktionsmodus mit Membran-Mikrodomänen (Lipid Rafts)
4. Auswirkungen von Glykosylierungsmodulatoren auf das Spike-Glykoprotein und seine Interaktion mit Darmzellen.
5. Auswirkungen einer Virusinfektion auf den Handel und die Funktion wichtiger Enzyme der Darmphysiologie (APN, SI, LPH, DPP4).
Dieses Projekt wird wesentliche Informationen zur Replikation von SARS-CoV-2 in Darmepithelzellen liefern, seine Auswirkungen auf die Darmfunktion bewerten und solide Hypothesen auf molekularer und biochemischer Basis für die Symptome von SARS-CoV-2-Infektionen liefern. Diese Hypothesen können dann zu einem späteren Zeitpunkt an Darmorganoiden überprüft werden. Darüber hinaus könnte die Aufklärung des Biosynthesewegs, des Glykosylierungsmusters und der Interaktionsart der SARS-CoV-2-Rezeptoren und ihrer Modulation hervorragende Ziele für eine potenzielle Therapie darstellen.
Biochemische und zelluläre Grundlage der Kohlenhydratmalabsorption bei Mikrovillus-Einschlusskrankheit und potenzielle Rettung der Bürstensaummembranfunktion
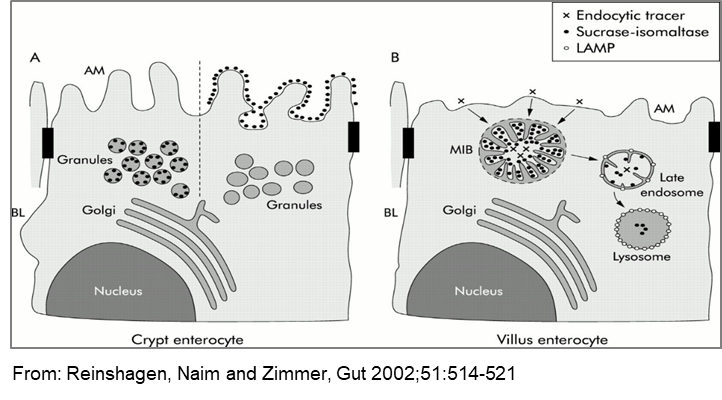
Die Mikrovillus-Einschlusskrankheit (MVID) ist eine seltene angeborene Erkrankung, die durch eine Zottenatrophie und das Vorhandensein von Mikrovillus-Einschlusskörperchen (MVIBs) gekennzeichnet ist. In experimentellen Einstellungen mit kationisiertem Ferritin in menschlichen Biopsien haben wir zuvor gezeigt, dass die Einschlusskörperchen aus der Autophagozytose der apikalen Zellmembran stammen und frühe Endosomen darstellen. Der Gendefekt bei MVID wurde inzwischen auf das MYO5B-Gen kartiert, das für das unkonventionelle Typ Myosin 5b Motorprotein kodiert. Myosin 5b ist in nicht polarisierten Zellen mit dem Plasmamembran-Recycling-System und in polarisierten Zellen mit dem apikalen Recycling-System verbunden. Darüber hinaus wurde gezeigt, dass das mit der Rab11-Familie interagierende Protein 2 mit Myosin 5b bei der Regulierung des Plasmamembran-Recyclings eine Rolle spielt. Diese Ergebnisse unterstreichen die Bedeutung der Aufklärung der zellulären Mechanismen der Autophagozytose der apikalen Membran von Enterozyten in MVID-Membranen mit dem letztendlichen Ziel, in diesem Zusammenhang geeignete therapeutische Maßnahmen zu entwickeln. In diesem Vorschlag werden wir Caco-2-Darm-Zellen erzeugen, in denen Myosin 5b herunterreguliert, abgereichert oder modifiziert wurde, und auf molekularer und biochemischer Ebene die Folgen für den Transport und das Targeting einer Reihe von Bürstensaummembranproteinen bewerten.
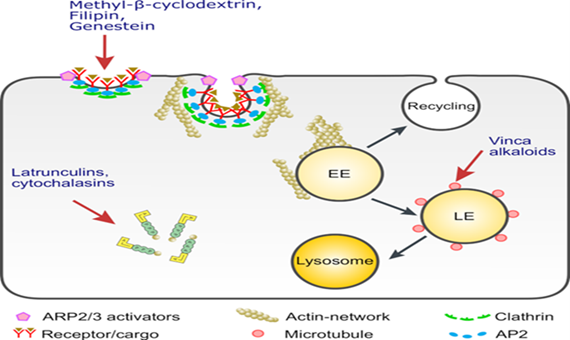
Wir werden die Funktion von Inhibitoren des Proteintransports und der polarisierten Sortierung sowie des vesikulären Transports in Myosin 5b-depletierten Caco-2-Zellen als Potentiatoren für die Rettung der Bürstensaummembran weiter untersuchen. Die aus dem Zellkulturmodell gewonnenen Daten werden bestätigt und auf Darmorganoide erweitert, die aus Darmbiopsien von MVID-Patienten generiert werden. In diesem Modell werden wir ähnliche Fragen wie im zellulären Modell ansprechen und Ziele identifizieren, um (i) die Bildung von MVIBs zu verhindern und (ii) eine mögliche Wiederherstellung des ordnungsgemäßen Transports und der Sortierung von Darmproteinmarkern und die Verringerung der Kohlenhydratmalabsorption zu ermöglichen. Das ultimative Ziel besteht darin, Inhibitoren und Modulatoren dieser Targets zu testen, die für Enterozyten am wenigsten toxisch sind. Diese Substanzen wären dann geeignete Kandidaten für klinische Studien an MVID-Patienten. Substanzen wie Vincristin (Zytostatika) und Chlorpromazin (Neuroleptika) sind bereits zugelassene Medikamente zur Behandlung von Kindern, jedoch nicht für die Anwendung bei MVID.